叶绿素荧光成像技术已成为研究植物光合生理、表型分析等的必备仪器技术,如今市面上有很多自称可以进行叶绿素荧光成像的设备,既有进口的,也有国产的,其中不乏存在一些忽悠、故弄玄虚、产品不成熟甚至存在严重缺陷并不被学术界认可(没有权威的参考文献做支撑甚至根本没有参考文献)等问题,宣传彩页或者含糊其辞、或者乱加引用其它仪器技术的参考文献图片、甚至作假图片等。如果购买了这样的仪器设备,实验成果很可能存在错误或漏洞和误导、很难在国际学术期刊上发表等问题。本文主要针对叶绿素荧光动态成像技术,就如何选配叶绿素荧光成像仪器设备问题做一简单介绍,所介绍的仪器设备都是国际上学术界普遍采用的、每年都借以发表大量文献、被学术界广泛认可的技术产品。
一、叶绿素荧光成像技术的发展
1、传统叶绿素荧光仪
20世纪八九十年代,叶绿素荧光检测技术逐渐成熟。目前主流的商用叶绿素荧光仪主要有以下三大技术路线:
从左至右:OJIP快速荧光动力学曲线、PAM荧光淬灭动力学曲线、QA–再氧化动力学曲线(Kalaji, 2014)
其中FL6000(原FL3500)双调制式叶绿素荧光仪无疑是目前功能最全面、性能最强的一类叶绿素荧光仪。而最新技术可以在手持式小型仪器(FluorPen/AquaPen)中融合PAM脉冲调制和OJIP两类测量技术,并集成PAR光合有效辐射和OD光密度传感器,甚至可以在国际空间站上进行科研工作。

上图:FL6000双调制式叶绿素荧光仪;下左图:FluorPen/AquaPen手持式叶绿素荧光仪;下右图:NASA宇航员使用FluorPen手持式叶绿素荧光仪在国际空间站新一代先进植物培养器(Advanced Plant Habitat,APH)中进行测量
2、叶绿素荧光仪的局限性
在多年的仪器使用研究之后,科学家们逐渐发现了叶绿素荧光仪有一些难以解决的局限性。
左图:仅能测量一点的叶绿素荧光仪无法全面反映植物的情况;右图:叶绿素荧光仪的结果仅能反映测量点的状况
左图:叶绿素荧光仪难以测量的植物样品;右图:面对大量小型样品时,荧光仪经常无能为力
3、叶绿素荧光成像技术的出现与成熟
随着Charge-Coupled Device(CCD)相机技术、电脑图像分析技术以及LED光源板技术的成熟,从上世纪八十年代末开始,叶绿素荧光成像技术开始逐渐发展起来(Daley et al.1989; Raschke et al. 1990; Mott et al. 1993; Genty and Meyer 1994; Bro et al. 1995; Siebke and Weis 1995; Meyer and Genty 1998; Balachandran et al. 1994; Oxborough and Baker 1997;Nedbal 2004)。但这些研究一直局限于研究者实验室使用,难以商业推广,技术上也不成熟。
Ladislav Nedbal与Martin Trtilek等于20世纪90年代末期发明了与PAM技术相结合的叶绿素荧光成像技术(他们同时也是FL6000双调制式叶绿素荧光技术的发明者),研制成功了第一台FluorCam脉冲调制式叶绿素荧光成像仪(Nedbal,2000)并推出其商用型号。无论是叶绿素荧光权威书籍《Chlorophyll a fluorescence: a signature of photosynthesis》(Nedbal也是本书的合作作者之一),还是引用次数高达4600的叶绿素荧光研究综述《Chlorophyll Fluorescence: A Probe of Photosynthesis In Vivo》都将FluorCam调制式叶绿素荧光成像技术的出现作为叶绿素荧光研究真正进入二维时代的里程碑。之后又出现了多个叶绿素荧光成像商用仪器,其中有些品牌现在已经销声匿迹。而FluorCam还一直是叶绿素荧光研究的优中之选,更是愈来愈发展壮大,已成为世界上公认的权威植物光合生理与表型分析研究仪器。
左图:FluorCam叶绿素荧光成像仪的最初设计与其发明者;右图:目前FluorCam的主要型号
二、如何选配叶绿素荧光成像系统
在选配仪器时,我们都要考虑这样两个相互关联的问题:
那么,面对厂家的宣传,我们应该如何确定真正技术优秀又适用于自己的仪器呢?我们可以从以下四点逐一考察:
1、文献发表情况
在进行实验设计之前,我们都需要阅读大量的文献。这不但是为了从前人的研究中获得实验思路和灵感,也是为了从文献中发现测量数据精确可靠、国际认可度高的仪器。这从发表文献的数量和质量上可以有一个直观的认识。
2019年-2021年,每年使用FluorCam叶绿素荧光成像技术发表的SCI文献都保持在150篇以上。2022年更是达到200篇以上。其中国内科研院所利用FluorCam发表文献量占比也在逐年攀升。这既说明中国科学家对FluorCam叶绿素荧光成像技术有极高的认可度,也说明中国的光合相关研究处于世界领先水平。
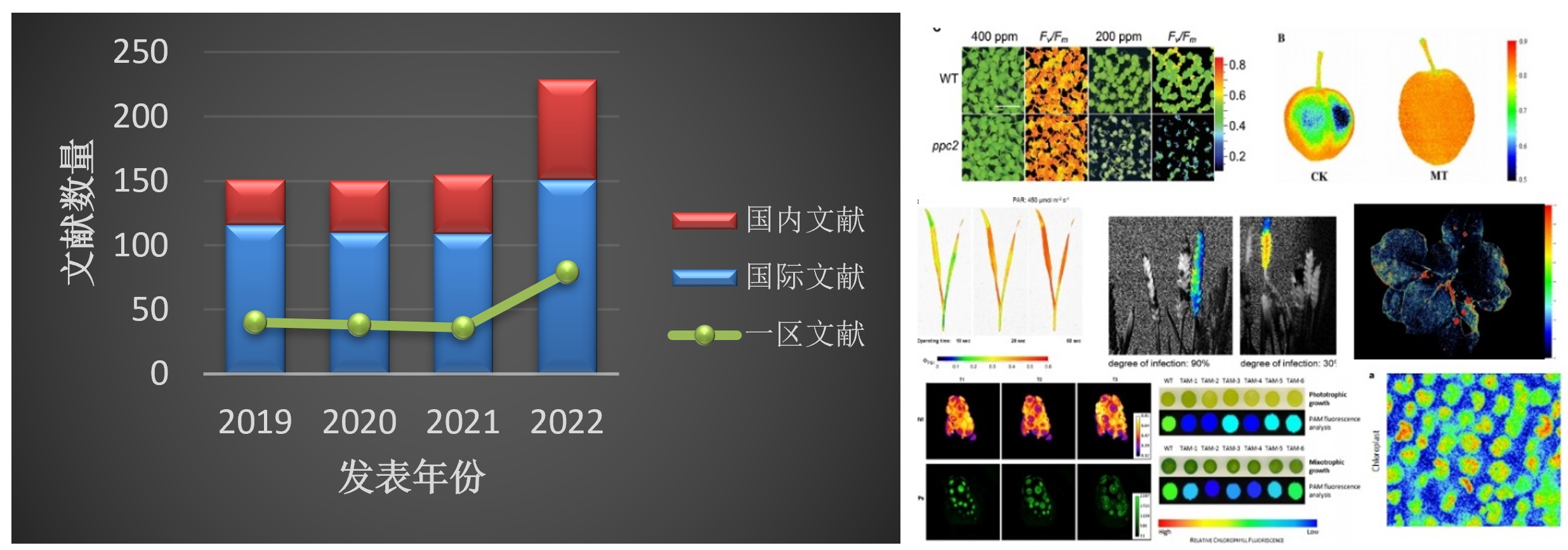
左图:使用FluorCam发表SCI文献的逐年趋势图;右图:部分文献中的荧光成像图
这些发表的文献中,中科院SCI期刊分区一区文献(按文献发表当年的中科院SCI期刊分区进行统计)数量同样稳中有进。2020年至2023年5月,一区文献发表量占同期全部发表文献量的30%。这其中包括发表于The Plant Cell、Nature Communications、Nature Plants、Cell、PNAS、Molecular Plant、New Phytologist、Plant Physiology等顶级期刊的文献。说明FluorCam技术发表文献的研究水平之高。
2、成像质量:荧光激发光源、成像传感器、实际成像图
1)荧光激发光源:光质(颜色)、成像面积、光强、光场均匀度
叶绿素荧光测量必须要用专门的荧光激发光源来激发荧光。根据用途,激发光分为测量光、光化学光和饱和脉冲光。在目前主流的叶绿素荧光成像仪器中,这些激发光都来源于仪器配备的LED光源板。
从光质(颜色)上来说,从紫外光到红光都可以激发叶绿素荧光。但光合色素(包括天线色素和光反应中心的叶绿素a)有其特定的吸收峰,因此叶绿素荧光仪器一般使用的光质为:
具体到每种激发光,测量光是用来测量最小荧光F0,而在激发F0时,要求光反应中心不产生电荷分离和热耗散,因此能级较低的红光就是最好的选择。饱和脉冲光用来暂时关闭光系统反应中心,因此高能级的蓝光或全光谱的白光更为合适。光化学光用来在测量过程中诱导植物发生光合作用,也就是模拟自然光照,因此红光蓝光均可,但最好的光质无疑还是更接近真实自然光照的白光。

左图:不同光合色素的吸收光谱;右图:不同光质激发叶绿素荧光的过程
由此推荐的光源配置如下(有的叶绿素荧光成像仪器只能配备一种颜色的光源,那就没有办法了):
FluorCam可以在一台仪器中同时配备红光+白光和红光+蓝光的双色光源,还可以定制青光、绿光、琥珀光、深红光、紫外光等各种不同光质的光源,而且每种光源均为专用的均匀阵列光源板,实现荧光激发的最优化。

FluorCam系统配备的双色与多色LED光源板
同时,光源板的面积又是最佳成像面积的决定因素。FluorCam系统具备一系列不同成像面积的型号,从用来进行细胞级微观荧光测量的显微镜,到进行大型作物与冠层测量35×35cm成像面积的大型平台,均配备的专门对应设计的LED光源板。

针对不同大小的样品,专门设计的FluorCam型号
而光强、面积、光场均匀度这三个方面是相互联系的。光化学光一般要求最高达到1500-2000 µmol/m².s,饱和脉冲光一般要求最高达到3000-5000 µmol/m².s。但由于叶绿素荧光成像是在一个二维空间上进行同步检测的,因此就要求在一定的成像面积上达到足够的光场均匀度。那么这个光场均匀又能保证足够光强的成像面积是由什么决定的?这绝不是厂家宣传资料上随便说的,这需要一系列软硬件技术的支持。
首先,点光源的光场必然会随距离衰减。因此对于叶绿素荧光成像仪器使用的光源板必须是均匀排列的LED阵列,而且每块LED光源板的面积至少要和成像面积一样大。这样点光源阵列的光场叠加才能保证相同成像面积中的光场是均匀的。如果光源阵列本身就不是均匀的,那么怎么可能保证光场是均匀的呢?

左图:点光源光场;中图:均匀点光源阵列的光场示意图;右图:某叶绿素荧光成像仪器品牌的非均匀光源板
但由于光源光场的边际效应,仅仅这样还是不够的。为了获得更好的成像效果还需要有更进一步的技术保障。一种方法是使用两块同等面积的LED光源板各自斜向45°相对排列,使同等面积上叠加的LED数量提高一倍。比如FluorCam开放式和封闭式叶绿素荧光成像系统就是使用这种方法,4块13×13或20×20cm的光源板两两成组,保证相应成像面积中光场的均匀度。另一种方法是增加光源板的面积。比如FluorCam大型叶绿素荧光成像平台使用大于70×70cm的光源板来确保成像中心35×35cm的光场均匀度。

左图:FluorCam开放式的4块成组对向安装的光源板,中图与右图:FluorCam大型成像平台的70×70cm光源板和实际测量情况
2、成像传感器
目前主要的成像传感器有CCD和CMOS两种。两种传感器各有优劣。目前,荧光成像类仪器是以CCD传感器为主。
成像传感器有两个关键技术指标:图像分辨率与成像速度。更高的图像分辨率能够获得更清晰的荧光成像图。那么成像速度的重要性在哪里呢?
叶绿素荧光是一种比较特殊的荧光,由于它的强度与光合电子传递链的生理状态密切相关,在测量过程中会快速而剧烈的变化,其强度的变化曲线被称为叶绿素荧光动力学曲线。从数据的准确度上考虑,成像速度直接关系到CCD能够灵敏捕捉到曲线的动态变化。因此,CCD成像速度的重要性还要高于图像分辨率。

FluorCam叶绿素荧光淬灭动力学曲线的测量过程
而这两项技术参数是有一定的相互影响的。一般来说,图像分辨率过大,必然会降低成像速度。因此在这两者之间,需要取得一个平衡。有的CCD传感器为了解决这一问题,采用了binning像素合并的数据处理方式,就是将一定数量(2的n次方)的像素点合并为一个像素点输出数据,从而提高成像速度,但实际获得成像图的分辨率也要降低同样的倍数。

binning像素合并的图像输出方式
某品牌叶绿素荧光成像仪器宣称其图像分辨率为1392×1040像素,成像速度为30帧/秒。但实际上1392×1040像素是在1×1 binning模式下,而30帧/秒则是在2×2 binning模式下。其在测量叶绿素荧光时为了确保成像速度,只能在2×2 binning模式下测量,最后得到的成像图只有696×520(1392/2×1040/2)。FluorCam则可以在1360×1024的图像分辨率下确保20帧/秒的成像速度。这是经过反复测试后获得的最佳平衡。
3、实际成像图
有的老师可能发现,某些品牌的叶绿素荧光成像仪器宣传资料上的成像图绚丽多彩、摇曳生姿。但其发表文献中的成像图却是模模糊糊一大团,不要说像FluorCam这样分辨出叶肉和叶脉,甚至连病斑、老叶幼叶都无法区分。从CCD和光源的技术参数上看起来没有什么问题啊?这是什么原因?

FluorCam宣传图与文献中的实际成像图(赫尔辛基大学Wen,2019)

某荷兰品牌叶绿素荧光成像仪器的宣传图与某篇文献中的实际成像图
我们先不考虑虚假宣传的问题,只从技术的角度来分析一下这个问题的原因。
目前的叶绿素荧光成像技术实际上是特指PAM脉冲调制式叶绿素荧光成像技术。只是对叶绿素荧光进行简单地成像是没有什么技术难度的。但是,只有通过PAM脉冲调制技术才能获得真正准确的荧光成像图与对应的数据。
PAM,即Pulse Amplitude Modulation脉冲振幅调制或脉幅调制。PAM实际上是一种信号检测方式。PAM脉冲调制式叶绿素荧光成像仪器在工作时,测量光按照一定的调制频率,以闪烁的光脉冲形式照射植物样品,成像CCD与测量光要进行严格地脉冲调制,即只记录测量光激发的、与测量光同频的荧光信号。

左图:PAM信号检测方式;右图:FluorCam叶绿素荧光淬灭动力学曲线的PAM脉冲调制
叶绿素荧光测量应用PAM技术的目的是:
那么如果一台叶绿素荧光仪器不是真正的PAM脉冲调制技术会怎么样呢?不但成像图质量大打折扣,同时由于最基本的最小荧光F0(也称为原初荧光,可以认为是叶绿素荧光的本底值)无法测准,后续所有基于F0计算的荧光参数全部都不可靠。这样的仪器就算是发表了文献,经常会出现完全超出叶绿素荧光参数理论范围的结果。这样的数据结果和成像图又如何支持实验研究的结论呢?
所以说,不看广告看疗效。我们不能一味地相信厂家标称的技术参数,就如同我们买手机电脑不能单纯看硬件配置,更要关注品牌型号一样。而对于叶绿素荧光成像仪器,最好的方法就是找一下相关的文献,看一看实际的成像图效果与对应的数据结果。
3、软件功能:叶绿素荧光参数及对应成像图、无人值守自动测量、
1)PAM脉冲调制式叶绿素荧光参数
基于不同的实验目的,我们可以选择不同的Protocol获取荧光参数及对应的成像图:
在荧光淬灭动力学测量时,还有一个难题,就是如何测量光适应条件下的最小荧光F0’。由于这光适应条件下,难以让测试样品达到原初状态,就没办法直接测量F0’。这不是PAM技术本身可以解决的。因此,由于技术限制,很长一段时间内叶绿素荧光仪器都不能直接测量F0’。1997年,Oxborough和Baker提出了一个F0’的估算公式:
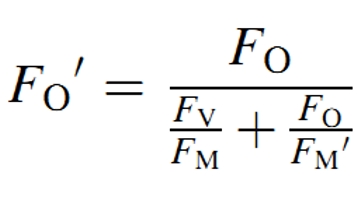
之后的一系列研究证明,这个公式估算得到的数据是可信的。但这个数据终究不是直接测量得到的。在很多研究尤其是光系统状态转换研究中,这样的数据是不能使用的。随着技术的进步,FluorCam通过配备专用的远红光源板进行调制照射,使测量样品达到原初状态,从而实现对F0’进行实测。从另外一个方面说,没有配备远红光源或者是虽然有远红光,但不能对其进行调制测量的叶绿素荧光仪或者荧光成像仪都是不能实际测量F0’的。
2)自定义编辑protocol与参数
对于特定光合作用机制的深入研究,一般常用的测量Protocol可能就无法满足需要了。比如中科院植物所光合作用研究中心、河南大学和瑞士日内瓦大学合作,研究拟南芥内腔硫醇氧化还原酶LOT1与丝氨酸/苏氨酸蛋白激酶的功能性氧化还原链接。光合有机体为了应对光强和光质变化,需要进行状态转换来优化光合产额并减轻光损伤。而这一过程与之密切相关。因此通过光合系统状态转换过程中叶绿素荧光的动态变化是研究这一过程的最佳方法。

左图:状态转换过程的荧光动力学曲线、荧光成像图及荧光参数;右图:由易科泰生态实验室为本研究定制的protocol程序部分语句
本研究通过FluorCam自定义编辑protocol功能,完美实现了光合状态转换的光照模拟与荧光动力学曲线检测(上图A、B),同时自动计算了状态转换参数qST(上图D)并生成了相应成像图(上图C),并与最大光化学效率Fv/Fm进行了对比(上图F),为本次研究提供了极为重要的数据证明。
3)荧光成像图模式
FluorCam软件可提供不同的成像数据处理模式以供用户获得最符合实验需求的彩色成像图:

左图:病毒感染不同基因处理的拟南芥;中图:利用细胞悬液进行敌草隆生物毒性快速检测;右图:番茄种苗活力快速定级
FluorCam软件还可以按不同的彩色标尺生成不同颜色范围的成像图:
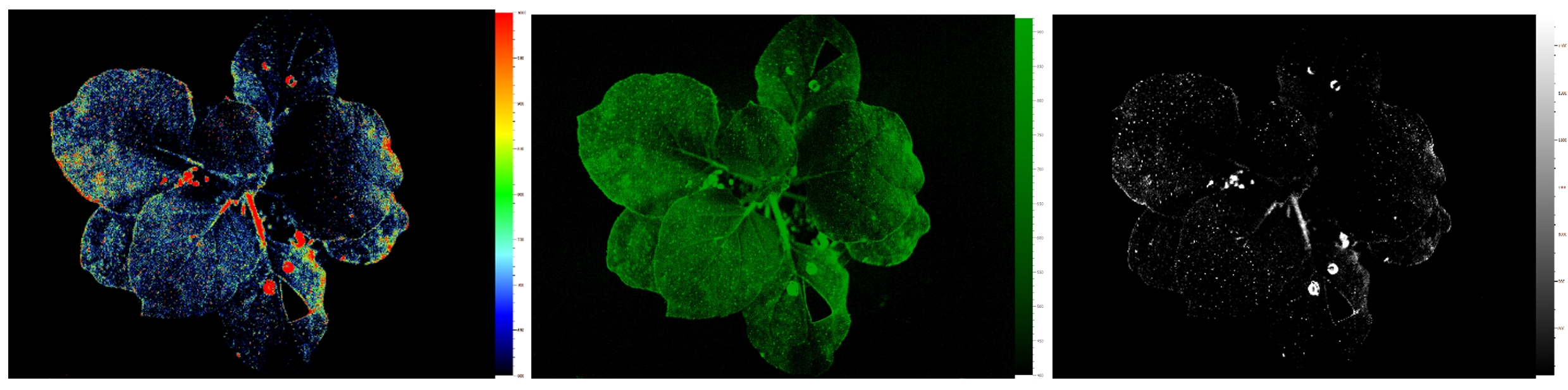
烟草GFP荧光成像图的不同彩色标尺成像图,左图:全光谱彩色标尺;中图:GFP模拟标尺;右图:白黑灰度标尺
4)无人值守自动测量
在胁迫等实验处理后,植物样品会随时间逐渐变化。如果用人工来测量这一动态变化过程的话,对人力损耗很大,时间上也难以精确。FluorCam提供无人值守自动测量功能则可以让研究者很轻松地进行这一类实验。
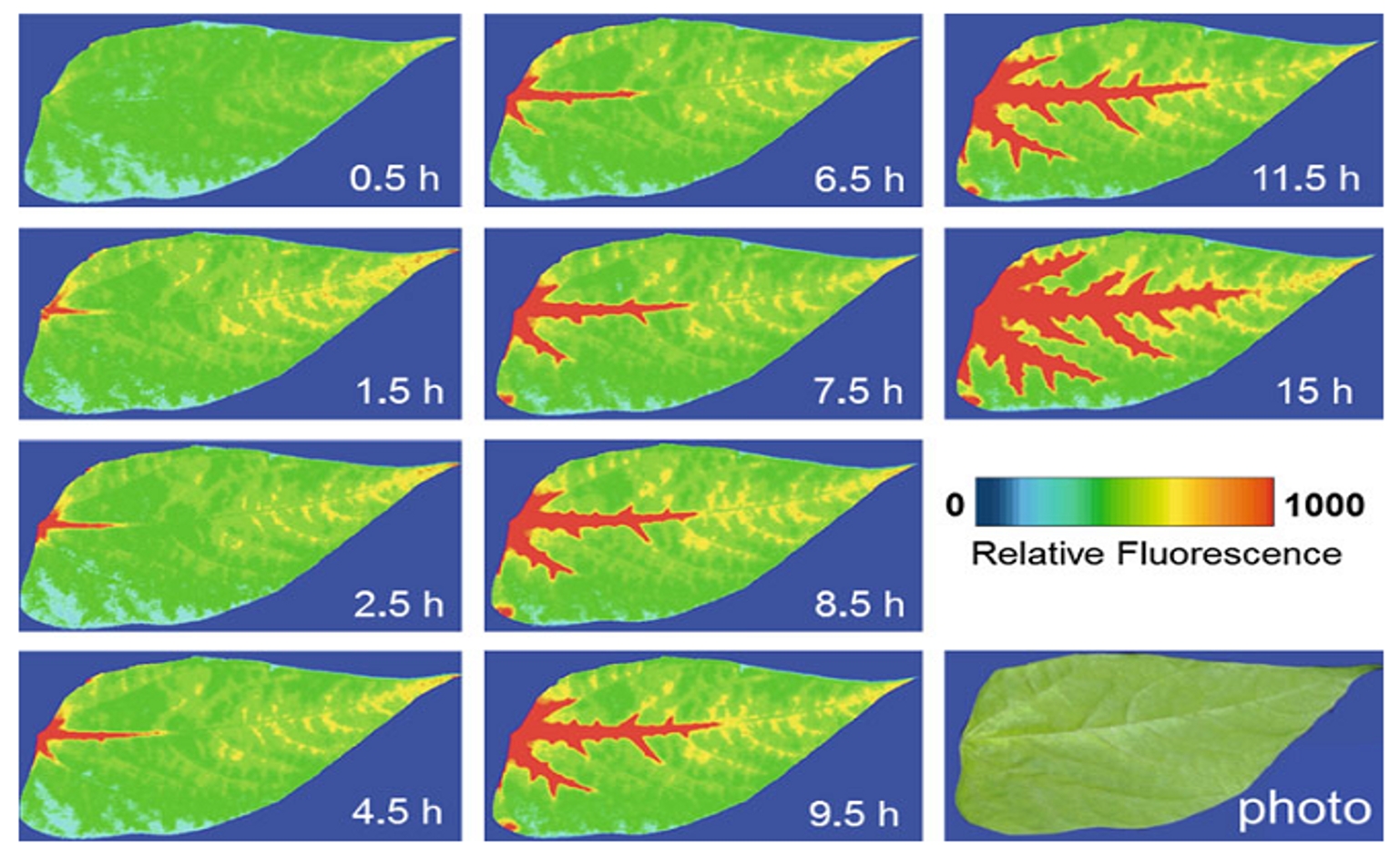
敌草隆吸收随时间对叶片的损伤(Lichtenthaler,2013)
5)图像定量分级(阈值分割)
植物样品在实验处理后,不同部位的受损程度不同。FluorCam软件提供阈值分割的方法来将成像图进行定量分级。比如将受胁迫的叶片按叶绿素荧光参数(如Fv/Fm)分为受损部位和健康部位,受损部位再进一步分为严重受损、中度受损和轻度受损。软件可以输出每种级别的成像图、平均荧光数据和实际面积。

大豆叶片感染病菌后的Fv/Fm叶绿素荧光成像图定量分级(Rousseau,2013)
4、扩展成像功能
如果一台叶绿素荧光成像仪器还能进行其他成像测量,一台仪器能当多台用,那不是大赚了吗?那么让我们看一下,以现在的叶绿素荧光成像技术而言,我们还能扩展哪些成像测量功能。
1)PAR吸收率成像
我们都知道叶绿素荧光参数电子传递速率ETR=ΦpsII×PAR×0.5×leaf PAR absorptivity。一般的公式中会默认植物光合有效辐射吸收率(PAR absorptivity)为0.84。但这仅仅是一个经验数据。对于不同植物、植物的不同部位、不同生理状态和生长阶段,其吸收率都是不同的。因此在实际应用中,光合有效辐射吸收率应该进行实测。光合有效辐射吸收率的实测是应用了植物反射光谱的原理。植物对红光是高吸收的,而对于近红外光则是高反射的。因此,通过红色光源与红外光源照射植物样品,测量植物样品对每种光源的反射率,根据公式计算得出光合有效辐射吸收率。其计算公式为(Ulstrup,2007):
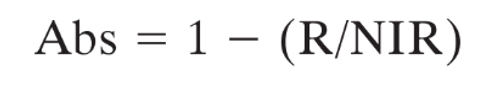
FluorCam通过配备专用的红色与红外光源板、相应的滤波轮和滤波片实现了对PAR吸收率以及NDVI植被归一化指数的成像,不但使ETR的计算结果更加真实可信,而且PAR吸收率和NDVI的变化也可以直接反应植物结构生理和叶绿素含量的改变等。
左图:植物在可见光和近红外区的反射差异;右图:FluorCam获得的PAR吸收率成像图
2)GFP、YFP、RFP、DAPI等荧光蛋白或荧光染料成像
在进行转基因植物研究时,经常需要用到GFP等各种荧光蛋白或荧光染料。以前在鉴定这些荧光蛋白表达时一般都是使用荧光显微镜对每一个样品逐一筛查,工作量很大。FluorCam由于能够配备多种不同波段的激发光源和相应滤波片,具备了对荧光蛋白的高通量宏观筛查的能力。同时由于其具备的荧光定量分析功能,还能对荧光蛋白的表达进行相对定量分析。

上图:FluorCam 拟南芥GFP成像图;下图:FluorCam 玉米RFP成像图;图中发出明亮颜色的植株即为表达了荧光蛋白的部位,其颜色越偏向红色,则表明其表达的荧光蛋白越多,可进行相对定量分析;黑色部位即为没有表达荧光蛋白
3)UV-MCF紫外激发多光谱荧光成像
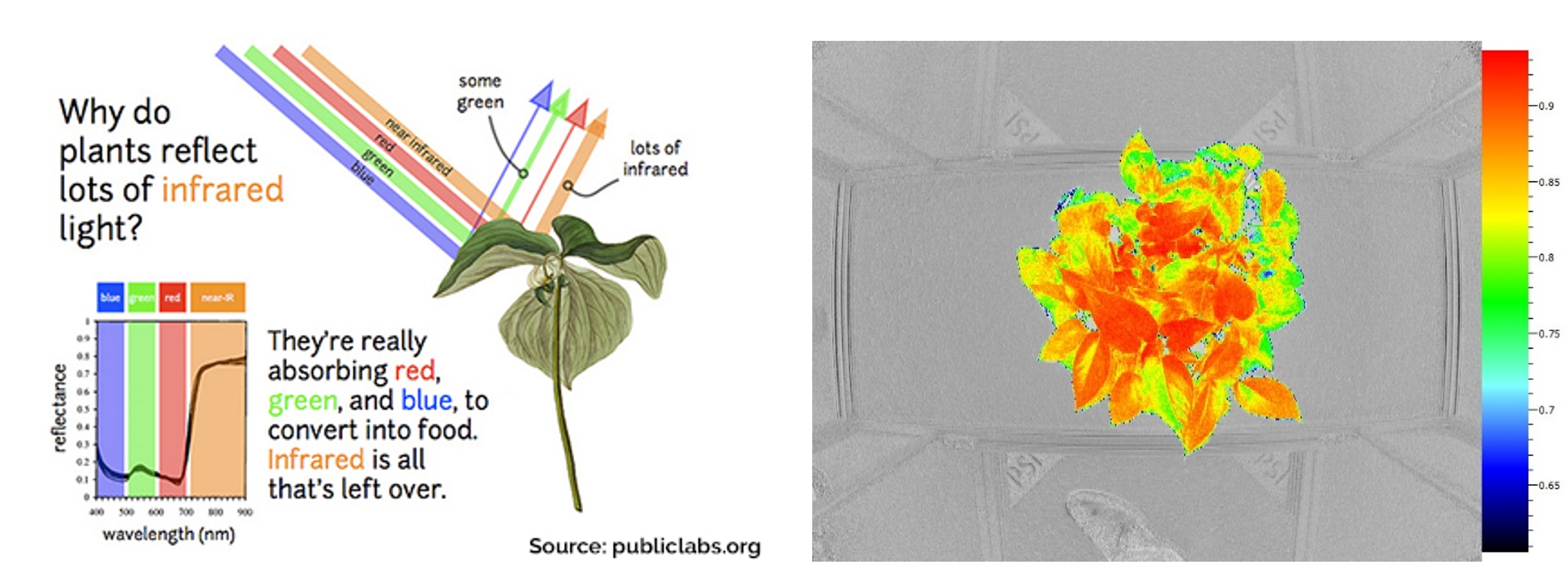
二十世纪八九十年代,植物生理学家和园艺学家对植物活体荧光——主要是叶绿素荧光研究不断深入。当科学家使用UV紫外光对植物叶片进行激发,发现植物产生了具备4个特征性波峰的荧光光谱。这4个特征性波峰的波长分别为蓝光440nm(F440)、绿光520nm(F520)、红光690nm(F690)和远红外光740nm(F740)。这个特征激发荧光光谱就称为多光谱荧光(Multi-color Fluorescence)。
左图:烟草叶片上表面UV激发荧光光谱(Buschmann,1998);中图:多光谱荧光彩色光谱示意图;右图:不同颜色激发光的荧光激发特性(Benediktyová, 2009)
进一步的研究发现,多光谱荧光与植物次生代谢总体水平、叶绿素浓度、胁迫早期指示等密切相关(Pineda, 2008),尤其在各种胁迫因素的早期识别与抗性评估中表现极为灵敏。
在最近十年间,西班牙国家研究委员会(CSIC)已经利用FluorCam多光谱荧光成像技术结合FluorCam叶绿素荧光成像技术、热成像技术,对多种蔬菜、水果的病害、养分、气候变化适应等开展了大量的研究。

西班牙国家研究委员会利用FluorCam多光谱荧光成像技术等开展的相关研究:左图:模拟温室效应下油菜的响应与健康状况;中图:西葫芦白粉病;右图:甜瓜细菌性软腐病
4)双调制式叶绿素荧光成像
如前文所说,PAM荧光淬灭动力学曲线、OJIP快速荧光动力学曲线和QA-再氧化动力学曲线分析是叶绿素荧光技术的三大主要测量技术路线,分别对应光系统运行机理的不同方面。与PAM荧光淬灭分析主要针对光系统运行中较慢的光合稳态与荧光淬灭不同,OJIP快速荧光动力学曲线和QA-再氧化动力学曲线分析都需要非常高的检测速度。
OJIP快速荧光动力学曲线测量要求对样品经过暗适应后的最小荧光上升到最大荧光这一过程进行快速检测。QA-再氧化动力学曲线测量是运用STF(single turnover flash,单周转光闪)测量光系统II中QA再氧化过程中荧光产额的衰减曲线,从而衡量QA传输电子的能力。
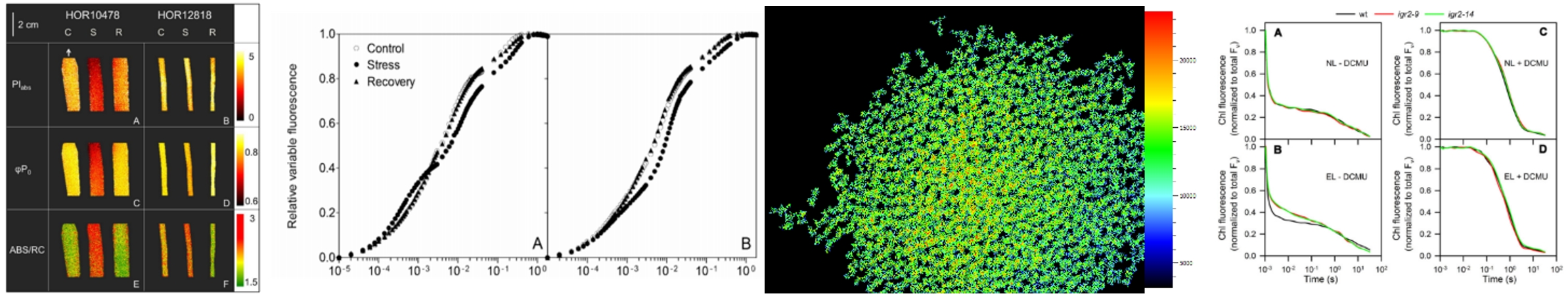
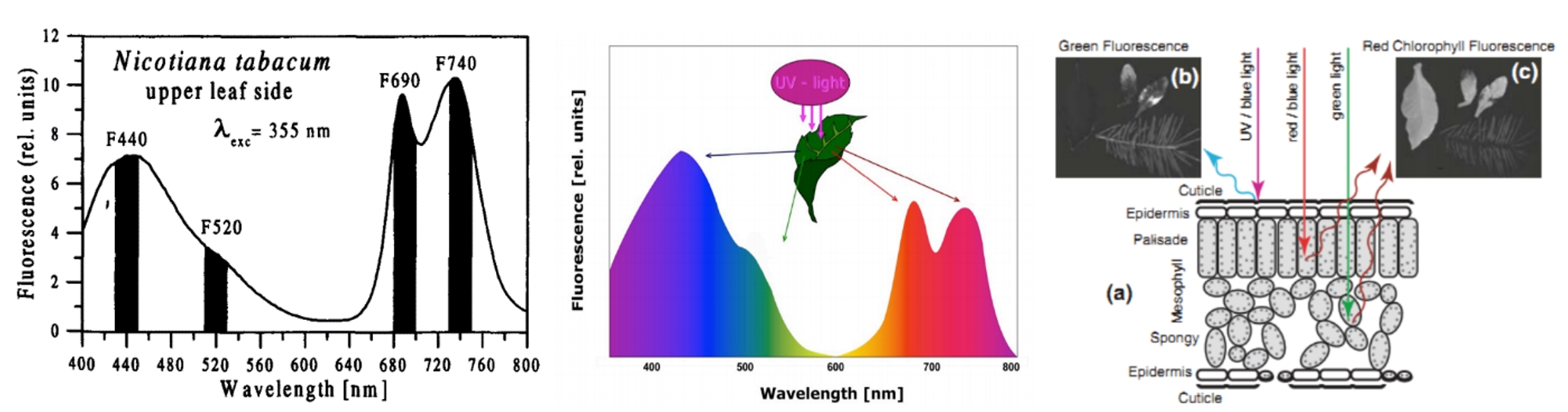
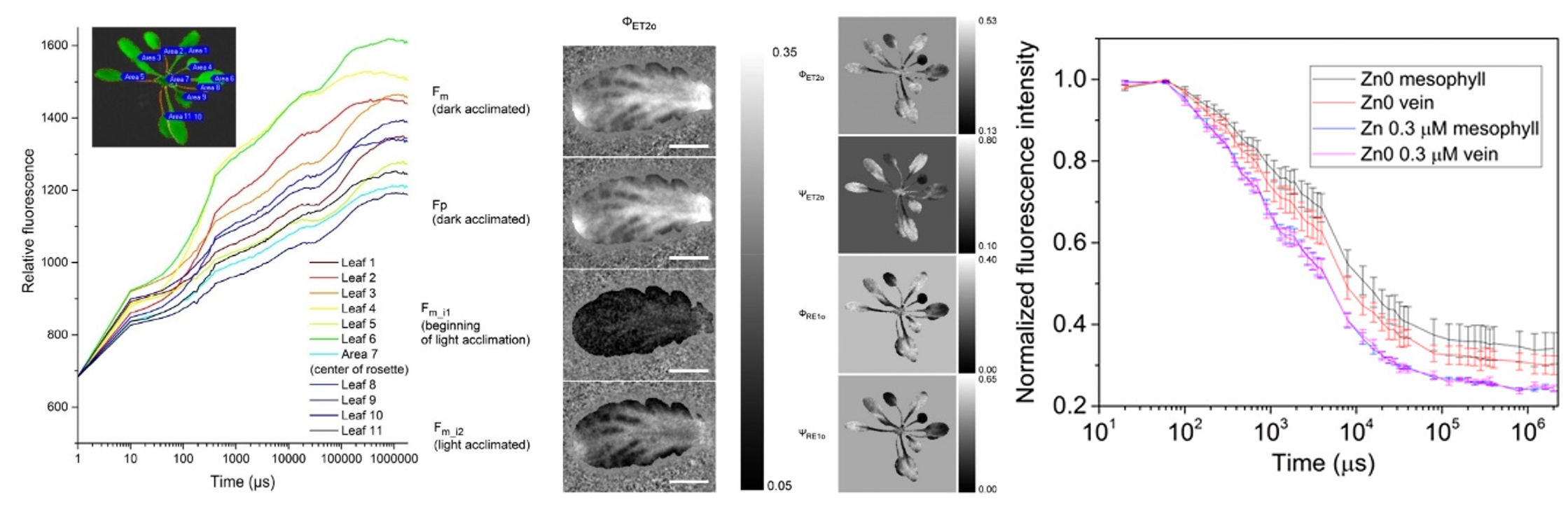
左图:使用FluorCam封闭式荧光成像系统获得的大麦OJIP参数成像图和动力学曲线(Jedmowski,2015);中图:使用FKM多光谱荧光动态显微成像系统测量紫菜显微QA-再氧化动力学成像图;右图:拟南芥的QA再氧化动力学曲线(Ding, 2016,中科院植物所)
这两种动力学分析在叶绿素荧光仪上是相对比较容易实现的。FL6000双调制叶绿素荧光仪就可以同时实现这三类动力学分析。但由于成像CCD元件的成像速度限制,一般叶绿素荧光成像仪器根本无法达到。国际上仅有FluorCam的两个型号——FluorCam封闭式荧光成像系统和FKM多光谱荧光动态显微成像系统通过泵浦成像技术分别实现了叶片层次与细胞层次的OJIP和QA-再氧化动力学曲线的拟合成像测量并得到国际学界的认可。

左图:FluorCam封闭式荧光成像系统;右图:FKM多光谱荧光动态显微成像系统
2019年,捷克科学院Küpper教授与PSI公司合作,首次将超高灵敏度成像传感器与叶绿素荧光成像技术结合,实现了在640×512图像分辨率下高达4000帧/秒的叶绿素荧光成像速度。这一技术实现了真正的OJIP快速荧光诱导动力学曲线和QA-再氧化动力学曲线成像测量
通过超高灵敏度FluorCam获得的拟南芥和超积累植物Noccaea ochroleucum的OJIP快速荧光诱导动力学曲线成像图(左图、中图)与QA-再氧化动力学曲线(右图)(Küpper,2019)
5)FKM多光谱荧光动态显微成像
目前主要的叶绿素荧光成像仪器都是针对宏观样品进行测量的。但很多研究中希望能够对单个微藻、大型藻或植物细胞乃至单个叶绿体直接进行叶绿素荧光成像测量,从细胞微观尺度对光合作用进行研究。于是,将FluorCam荧光成像技术与生物荧光显微成像技术有机结合的FKM多光谱荧光动态显微成像技术便应运而生。

FKM技术在藻类方面的一个突出研究成果是对蓝藻异形胞的持续研究,弄清了异形胞分化过程中光合特性的变化以及与蓝藻固氮的相互关系,乃至助力培育高固氮能力的蓝藻新品种。
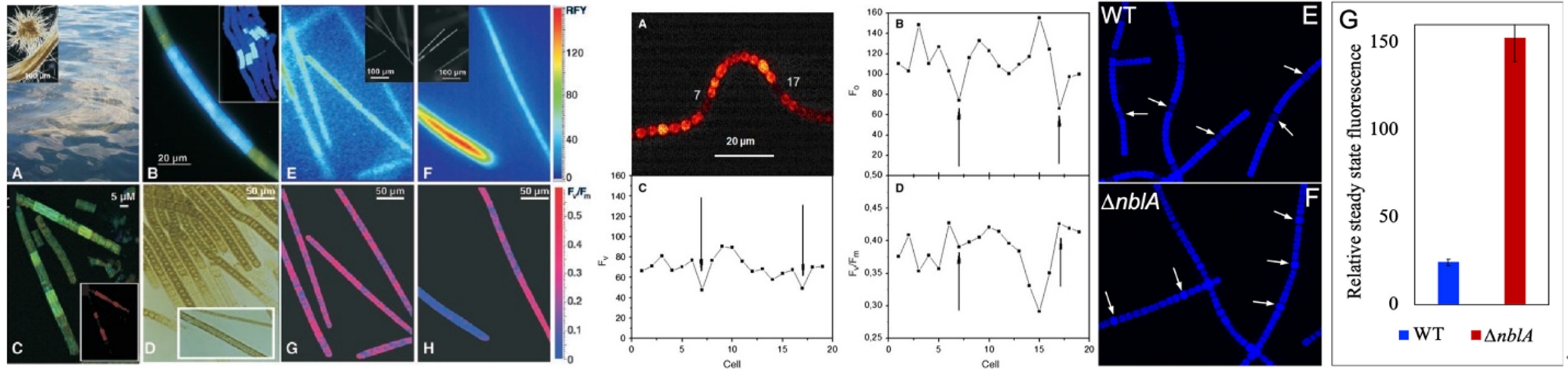
左:束毛藻叶绿素荧光与固氮酶的分布关系(Berman-Frank,2001);中:鱼腥藻异形胞PSII反应中心变化(Ferimazova,2013);右:异形胞藻胆素荧光极高的蓝藻新品种Anabaena 33047 ΔnblA(Bandyopadhyay,2021)
在高等植物方面,FKM技术则广泛应用于各种特殊的微观光合结构的功能研究,如秋海棠蓝色叶片中的特殊质体、玉米叶片“花环”结构等。

左图:秋海棠蓝色叶片中的特殊质体iridoplasts与叶肉细胞叶绿体的光合能力差异(Jacobs,2016);右图:干旱胁迫下玉米叶肉细胞叶绿体和维管束鞘叶绿体的光合能力差异(刘文娟,2020)
三、FluorCam 1300植物叶绿素荧光与多光谱荧光成像系统
时至今日,叶绿素荧光成像技术依然在不断更新升级。最后,我们简单介绍一下FluorCam系列的最新技术成果。
FluorCam 1300植物叶绿素荧光与多光谱荧光成像系统是FluorCam叶绿素荧光成像技术的最新升级产品。无需更换配件即可实现PAM脉冲调制式叶绿素荧光、UV-MCF紫外激发多光谱荧光和GFP、RFP、YFP等荧光蛋白和荧光染料的成像分析。测量对象包括叶片、果实、花朵、麦穗、整株小型植株、苔藓、微藻、大型藻类乃至特定的动物样品。

功能特点:


左图:不同颜色凌霄叶片RGB图;右图:叶绿素荧光成像图

凌霄叶片多光谱荧光成像图:F440与F520为次生代谢荧光成像图;F740/F690与叶绿素浓度及分布相关