自然界中的植物都会面临各种病害的侵染。病害防治更是农业生产中的重中之重。科学家们一直致力于用各种技术研究植物病害的发病机制和防治方法。在近年的最新研究中,新兴的组学研究技术逐渐成为病害研究的热点。在各种组学技术中,从直观、无损、快速、简便以及农业应用推广上考虑,植物表型成像分析技术无疑是最优的选择之一。

PlantScreen植物表型成像分析系统及表型成像图
传统表型概念里以形态学指标为主。而现代植物表型成像分析技术已经不局限于形态学,其主要应用的成像技术如下,它们在植物病害研究分别反映植物的不同表型变化与生理过程:
| 技术类别 |
表型与生理过程 |
病害研究用途 |
常用参数指标 |
| 叶绿素荧光成像技术 |
植物光合能力、光合电子传递链、光系统热耗散等光合生理过程 |
评估病害对光合系统损伤程度与机制;由于光系统对胁迫的敏感性,是病害早期预警的最灵敏且最常用技术之一 |
最大光化学效率Fv/Fm、实际光化学效率QY、非光化学淬灭系数NPQ、荧光衰减率“活力指数”Rfd等 |
| UV-MCF紫外激发多光谱荧光成像技术 |
植物在病斑及周边区域合成大量黄酮、多酚类次生代谢物,以防御病害的扩散 |
通过测量次生代谢物荧光,评估病害的发生程度与植物防御机制的激活 |
次生代谢物荧光F440、F520;叶绿素荧光F690、F740 |
| 形态成像分析技术 |
株高、株宽、叶面积、生物量、生长动态、色彩变化等形态的影响 |
评估不同条件下对植物形态的影响乃至增产效应 |
株高、叶面积及病斑面积、数字生物量等 |
| 多/高光谱(反射光谱)成像分析技术 |
通过反射光谱的变化定量反映植物活力、色素组成、光合作用、生化组成、氮素营养、水分含量等表型生理,对病害的影响进行间接测量。 |
病害对从健康程度、色素组成、营养状况等方面的影响,同时也配合叶绿素荧光成像技术对病害抗性进行进一步验证。 |
归一化植被指数NDVI、光化学反射指数PRI、花青素反射指数ARI、胡萝卜素反射指数CRI等 |
| 红外热成像技术 |
获得植物表面温度分布图及温度数据 |
通过叶片温度反映由于病害导致的叶片气孔导度变化、代谢紊乱等 |
平均温度、温度范围、水胁迫指数I |
植物病害的病原体有病毒、细菌、真菌。而植物种类又有模式植物、谷物、蔬菜、水果等。植物表型成像分析技术能够应对这些不同的研究需求吗?我们从具体的文献案例里查找答案。上一期我们介绍了抗病毒基因、蔬菜水果的叶片细菌病害相关研究案例,本期则主要介绍蔬菜、水果叶片与根系细菌、真菌病害;水稻细菌病害;病毒病害高通量表型分析等研究案例。
一、蔬菜、水果叶片与根系细菌、真菌病害表型分析
西班牙国家研究委员会(CSIC)综合利用植物表型成像技术对病害进行的相关研究已经持续了近10年。研究人员利用FluorCam叶绿素荧光成像技术、FluorCam UV-MCF多光谱荧光成像技术、热成像技术从时间和空间尺度上分别反映病原体感染对光合作用、次级代谢、气孔导度的影响。研究方向涉及多种细菌、真菌和蔬菜、水果,下面列举部分研究成果:
细菌性软腐病菌Dickeya dadantii是农业上的重要病害。这种病菌会先围绕一个萎黄环出现多个坏死斑点,进而整个感染区域坏死并逐渐扩展到周围的组织中。研究人员使用这三种技术对甜瓜叶感染Dickeya dadantii进行了成像测量,同时通过机器学习来处理这些成像技术获得的数据,建立数学算法来分类叶片感染区域,从而快速识别病害的发生。
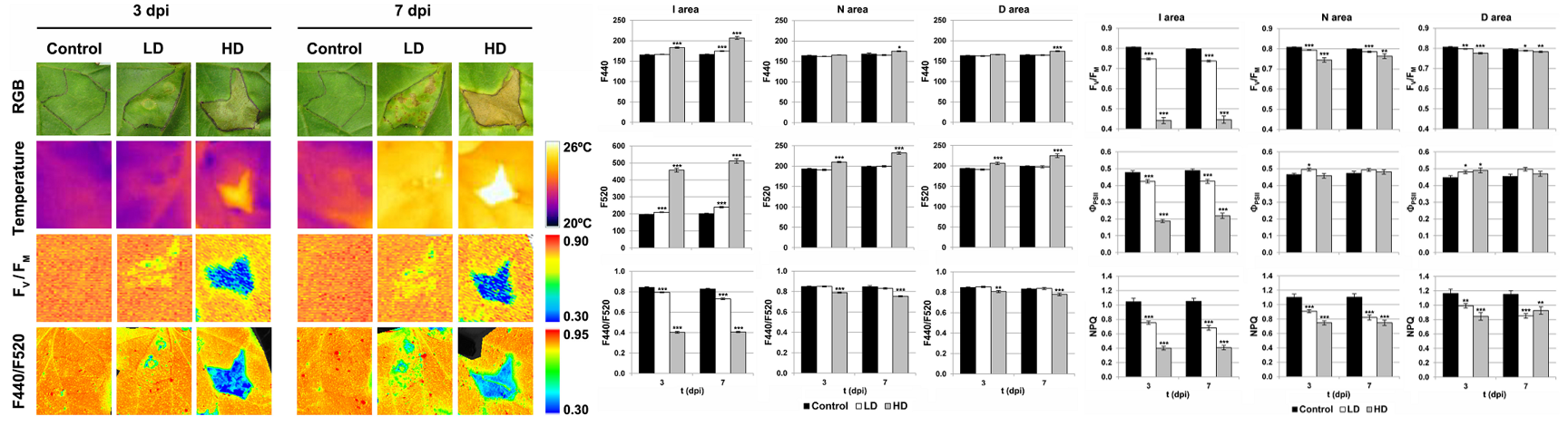
甜瓜叶感染Dickeya dadantii不同时期的叶绿素荧光成像、UV-MCF多光谱荧光成像和热成像图及相关数据
相同的仪器技术也可用于研究真菌引起的植物叶片病害,比如由真菌Podosphaera fusc感染引起的白粉病。通过对感染白粉病的西葫芦叶片进行FluorCam UV-MCF多光谱荧光和热成像分析,发现UV-MCF多光谱荧光参数F520/F680对于识别白粉病特别灵敏。而热成像与F440成像结果则表明,白粉病对叶片气孔关闭与次生代谢物合成的影响也是非常显著的。
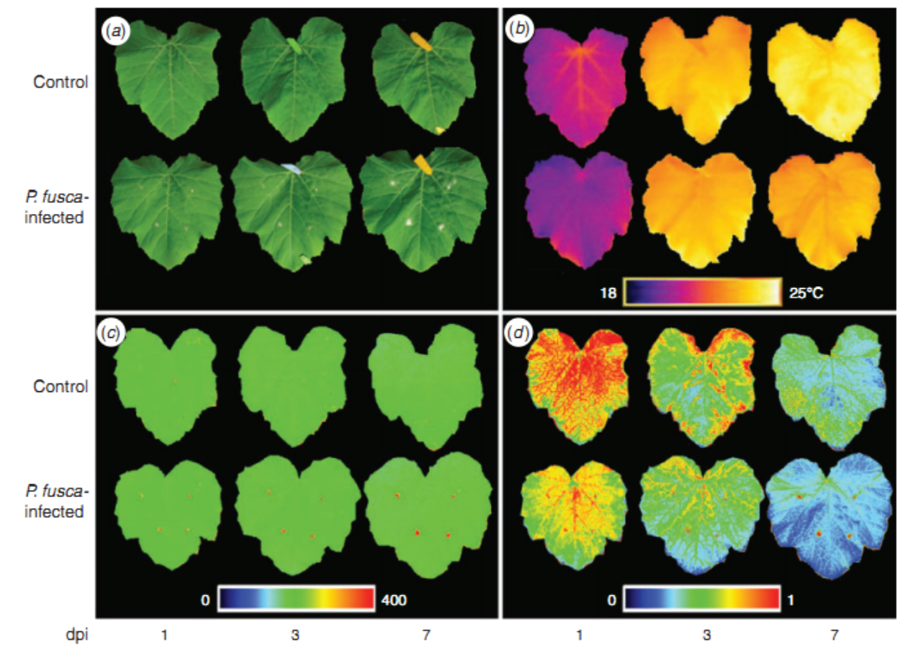
感染白粉病的西葫芦叶片:(a)RGB成像(b)热成像(c)多光谱荧光F440成像(d)多光谱荧光F520/F680成像
CSIC的研究人员还发现可以通过植物表型技术检测植物的地上部来发现根系的病害。比如被根系寄生杂草列当Orobanche cumana Wallr寄生的向日葵,真菌Rosellinia necatrix引起的牛油果根系白纹羽病等。这些研究为根系病害的前期发现与防治提供了有力的技术支持。
左图:根系寄生列当的向日葵叶片多光谱荧光成像与热成像分析;右图:根系感染白纹羽病的牛油果叶绿素荧光与多光谱荧光分析
参考文献:
1. Pineda M, et al. 2018. Detection of bacterial infection in melon plants by classification methods based on imaging data. Front. Plant Sci. 9(164), doi: 10.3389/fpls.2018.00164
2. Pineda M, et al. 2017. Use of multicolour fluorescence imaging for diagnosis of bacterial and fungal infection on zucchini by implementing machine learning. Functional Plant Biology, https://doi.org/10.1071/FP16164
3. Ortiz-Bustos C M, et al. 2017. Use of Blue-Green Fluorescence and Thermal Imaging in the Early Detection of Sunflower Infection by the Root Parasitic Weed Orobanche cumana Wallr. Frontiers in Plant Science 8:833
4. Granum E, et al. 2015. Metabolic responses of avocado plants to stress induced by Rosellinia necatrix analysed by fluorescence and thermal imaging. Eur J Plant Pathol, DOI 10.1007/s10658-015-0640-9
二、水稻稻瘟病、白叶枯病与干旱抗性的无损定量检测
在农业生产实践中,作物经常会同时面临生物和非生物胁迫的双重影响。水稻作为种植面积最广的作物,从而面临一系列的环境挑战。在热带和亚热带地区,水稻面临的最主要非生物胁迫就是干旱胁迫,同时如稻瘟病、白叶枯病等病害也会严重降低水稻的产量。
捷克科学院全球变化研究所联合美国堪萨斯州立大学、国际水稻研究所等单位开展了这方面的研究。研究者通过FP100手持式叶绿素荧光仪、FluorCam便携式荧光成像仪和SpectraPen手持式光谱仪分别测量多种近等基因系水稻在不同胁迫下的叶绿素荧光参数与植被指数,试图在田间快速识别病害与干旱的发生。
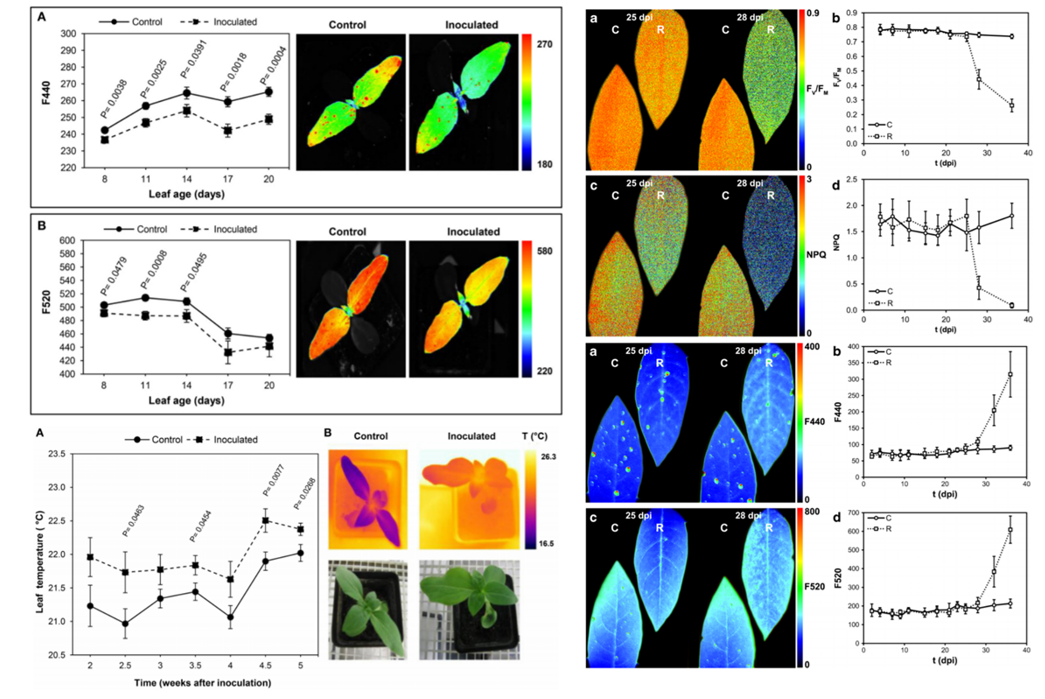
叶绿素荧光分析表明,光系统II最大量子产额Fv/Fm、实际量子产额QY_Lss和稳态叶绿素荧光Ft_Lss都可以有效地分辨稻瘟病和白叶枯病。而在进行干旱胁迫检测时,QY_Lss则效果不好。

左图:感染稻瘟病和白叶枯病的水稻;中图:实验中使用的手持式仪器;右图:叶绿素荧光成像图
通过光谱仪获得的植被指数则表明稻瘟病和干旱可以通过可见光波段的反射光谱植被指数来检测,而白叶枯病可以通过近红外波段相关的反射光谱植被指数来检测。
| 植被指数 |
公式 |
相关性 |
| 反射比RR |
R550/R675 |
稻瘟病 |
| 反射比RR |
R570/R675 |
稻瘟病 |
| 反射比RR |
R675/R700 |
叶绿素a |
| 反射比RR |
R672/R550 |
叶绿素b |
| 反射比RR |
R750/R550 |
总叶绿素 |
| 结构反射指数SRI |
R750/R700 |
总叶绿素 |
| 归一化植被指数NDVI |
(R755+R664)/(R755-R664) |
总叶绿素 |
| 反射比RR |
(R780-R710)/(R780-R680) |
总叶绿素 |
| 归一化光谱指数NDSI |
(R550-R410)/(R550+R410) |
叶绿素b |
| 光化学反射指数PRI |
(R531-R570)/(R531+R570) |
光合作用 |
| 类胡萝卜素反射指数CRI700 |
1/R510-1/R700 |
总类胡萝卜素 |
研究中使用的反射光谱植被指数
参考文献:
1. Šebela, et al. 2017. Chlorophyll fluorescence and reflectance-based non-invasive quantification of blast, bacterial blight and drought stresses in rice. Plant and Cell Physiology,59(1):30-43
三、植物病害高通量动态表型成像分析
植物感染病害后的表型改变是一个长期动态变化的过程。理想的表型研究当然是能对这一过程进行连续不断的监测。但如果用人工测量的方法太过费时费力,这就需要一种能够兼具植物表型成像分析、植物培养、自动传送的自动化系统。
赫尔辛基大学国家植物表型研究设施(National Plant Phenotyping Infrastructure,NaPPI)先后装备了2套PlantScreen高通量自动化植物表型成像分析系统:一套适用于50cm以下的小型植株,如拟南芥或作物幼苗等;一套适用于120cm以下的大型植株,如小麦、玉米等。

赫尔辛基大学装备的两套PlantScreen植物表型成像分析系统:一套适用于50cm以下的小型植株,如拟南芥或作物幼苗等(上图);一套适用于120cm以下的大型植株,如小麦、玉米等(下图)
赫尔辛基大学的研究人员利用PlantScreen系统研究了甘薯被羽毛斑驳病毒(SPFMV)和褪绿矮化病毒(SPCSV)感染后的表型动态变化。通过连续29天的RGB形态成像、叶绿素荧光成像与红外热成像分析,综合评估了两种病毒对甘薯造成损伤的严重程度。而在病害损伤评估中最灵敏的参数是实际光化学效率ΦPSII和光化学淬灭系数qP。而表型数据的变化又与病毒的分布与积累有明确的相关性。

左图:RGB、叶绿素荧光成像、热成像彩图;右图:叶绿素荧光参数和叶温的动态曲线
参考文献:
1. Wang L, Poque S, Valkonen JPT. 2019. Phenotyping viral infection in sweetpotato using a high-throughput chlorophyll fluorescence and thermal imaging platform. Plant Methods, 15, 116
北京易科泰生态技术公司提供植物病害表型全面技术方案:
l FluorCam叶绿素荧光/多光谱荧光技术
l PlantScreen植物高通量表型成像分析平台
l FluorPen手持式叶绿素荧光仪、SpectraPen手持式植物高光谱仪
l PhenoPlot®轻便型植物表型成像分析系统
l PhenoPlot®悬浮双轨式表型成像分析系统
l PhenoTron®-HSI多功能高光谱成像分析系统
l PhenoTron®复式智能LED光源培养与光谱成像分析平台
l PhenoTron®PTS植物光谱成像分析平台
l PhenoTron®-XYZ表型成像分析系统