表型组学(Phenomics)和代谢组学(Metabolomics)是系统生物学的两个重要分支,它们都致力于全面理解生物体的生物学特性,在研究的焦点和方法上有所不同。表型组学,研究的是生物体的表型,即生物体的物理、生理生化特征。这些特征是基因型和环境相互作用的结果。代谢组学则专注于生物体在特定生理或病理状态下的代谢物变化。代谢物是细胞代谢活动的产物,反映了生物体的实时生化状态。代谢组学通过分析这些代谢物的组成和变化,可以揭示生物体对环境变化的响应机制。
表型的变化往往与代谢物的变化密切相关。例如,植物在受到环境胁迫时,其形态和生理特征的变化(表型变化)往往伴随着代谢途径的调整(代谢物变化)。表型组学提供了生物体宏观层面的特征信息,而代谢组学则提供了微观层面的生化信息,为表型组学提供分子层面的解释,帮助研究者理解观察到的表型变化背后的生化机制,两者相辅相成,互为补充。
表型组学一般通过高通量表型技术,如成像技术、传感器技术等,来测量和分析生物体的形态、生理等特征。叶绿素荧光成像技术、荧光高光谱成像技术、RGB成像、红外热成像等是表型组学研究的重要技术之一,是检测植物初级代谢(光合作用)、次生代谢产物水平、形态学指标、温度(气孔导度与蒸腾作用)的重要手段。
易科泰拥有多项表型技术专利及数款表型检测设备,以下便通过4篇文章,分享易科泰表型技术产品在植物代谢组学研究中的具体应用。
(温馨提示,参考文献附后,可检索原文详细阅读)
案例1:表型组学和代谢组学数据结合揭示了基于蛋白质水解物的生物刺激剂在盐胁迫处理的莴苣和番茄中的不同作用模式(Frontiers in Plant Science,2022)
植物表型组学正成为表征生物刺激剂作用模式的常用工具。将这种技术与其他组学,如代谢组学相结合,可以提供对植物中的生物刺激效应的更深入的理解。然而,数据分析和组学数据集的解释具有一定的难度。本研究便是基于此做的一次尝试和示例。
研究者使用植物表型组学和代谢组学的方法,研究了不同来源的蛋白质水解物(PH)生物刺激剂对生菜和番茄在控制条件和盐胁迫下的影响。结果表明,生菜和番茄植物在盐胁迫下的生理响应不同,盐胁迫主要在实验的后期阶段影响了生菜的生长和光合作用。另外,PHs改善了盐胁迫条件下植物的生长和光合作用性能,尤其在生菜中作用更明显。代谢组分析则揭示了PH处理在番茄和生菜植物中激活了不同的代谢途径,包括次级代谢、辅因子/电子载体和植物激素的生物合成。

使用PlantScreen表型系统对处理的样本进行红外热成像、叶绿素荧光成像、RGB顶部和侧面成像获得表型数据
通过高级统计工具处理大量数据集分析发现,在生菜中,与生物量相关的性状(如体积)是与PH生物刺激剂相关性最高的性状,而在番茄中,与光合作用相关的表型参数更为重要。研究表明,结合植物表型组学和代谢组学的数据,可以更深入地理解生物刺激剂的作用机制,并为植物生长促进剂和减轻胁迫的生物刺激剂的开发提供了新的见解。

莴苣植物的代谢变化。与对照样品相比,生菜植株的代谢过程(A)、次生代谢(B)和激素的生物合成受到了损害(C)
案例2:污泥衍生的营养物质和生物刺激剂刺激水稻叶片光合作用和根系代谢,增强碳水化合物、氮和抗氧化剂的积累(Chemosphere,2024)
污泥衍生的的营养物质和生物刺激剂(SS-NB)含有腐殖酸和蛋白质水解物,以及独特的植物激素和化感物质,这些外源物质可以促进植物光合作用,提高植物抗逆能力,另外还可以影响土壤生态和根系发育,从而刺激植物生长。
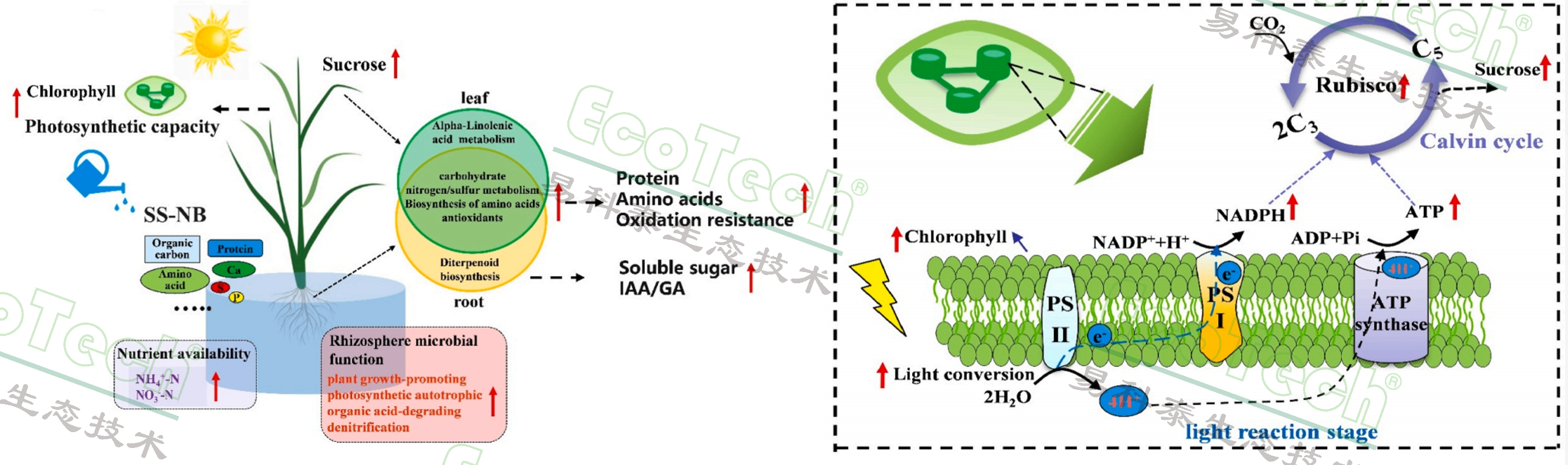
江南大学等单位发表的这篇文章中,研究了SS-NB对水稻叶片光合作用和根系代谢的影响,以及它们如何增强碳水化合物、氮和抗氧化剂的积累。研究发现,与氮肥(NF)处理相比,SS-NB 通过提高光合效率、叶绿素含量、ATP合酶活性、Rubisco和NADPH产生来增强水稻叶片的光合作用。同时,SS-NB 还增加了水稻叶片和根系中的抗氧化能力。代谢组学分析显示,SS-NB 应用增加了水稻根和叶组织中的代谢物表达水平,包括碳水化合物、氮和硫代谢、氨基酸代谢、抗氧化剂和植物激素。研究结果表明,SS-NB 在作物生长和逆境抗性改善方面具有很大的应用潜力。未来的研究应该关注SS-NB对作物品质和安全性的影响,以及它如何可能抵消长期施用化学肥料对作物生产和农业系统中根系-微生物相互作用的不利影响。
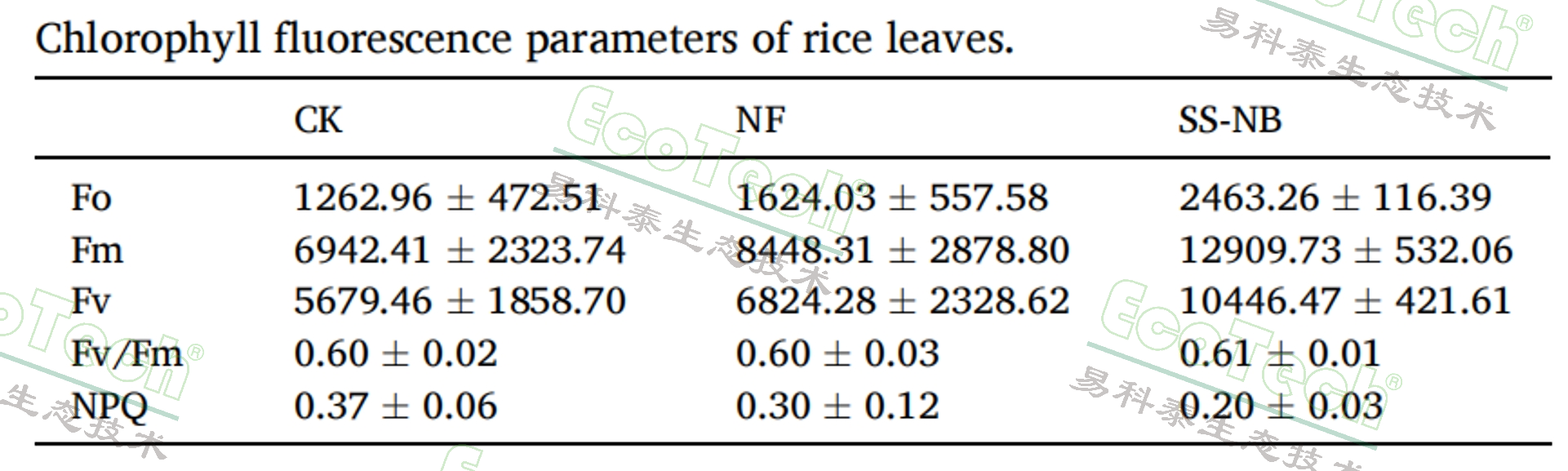
使用易科泰提供的FluorCam叶绿素荧光成像系统获得的不同处理的水稻叶片叶绿素荧光参数

叶片和根系代谢组分析SS-NB在糖酵解到三羧酸(TCA)循环过程中引起的代谢产物的变化
案例3:基于LC-MS的代谢组学研究,揭示了盐胁迫下蓖麻幼苗早期子叶和根的特定代谢变化(Plant Physiology and Biochemistry,2021)
幼苗发育早期是植物生命周期中最关键的时期之一,它极易受到不利环境条件的影响,特别是盐胁迫的影响。蓖麻是著名的非食用油料作物和耐盐作物,但其幼苗发育过程中耐盐的机制和代谢反应尚不清楚,本研究中,对16天大的蓖麻幼苗进行6天的盐胁迫,使用液相色谱-电喷雾离子化飞行时间质谱(LC-ESI-TOF-MS)进行代谢物分析,并结合生物量测量、叶绿素荧光成像测量、化学分析等方法,综合分析在盐胁迫下,蓖麻种子幼苗期的子叶和根系的特定代谢反应。
研究揭示了蓖麻幼苗在盐胁迫下子叶和根系的代谢变化,表明蓖麻能够通过调整碳分配策略、重新编程多种代谢途径以及在子叶和根系中积累不饱和脂肪酸来提高盐耐受性。研究结果为理解蓖麻在盐胁迫下的生理变化提供了新的见解,并为培育更具盐耐受性的作物品种提供了基础。
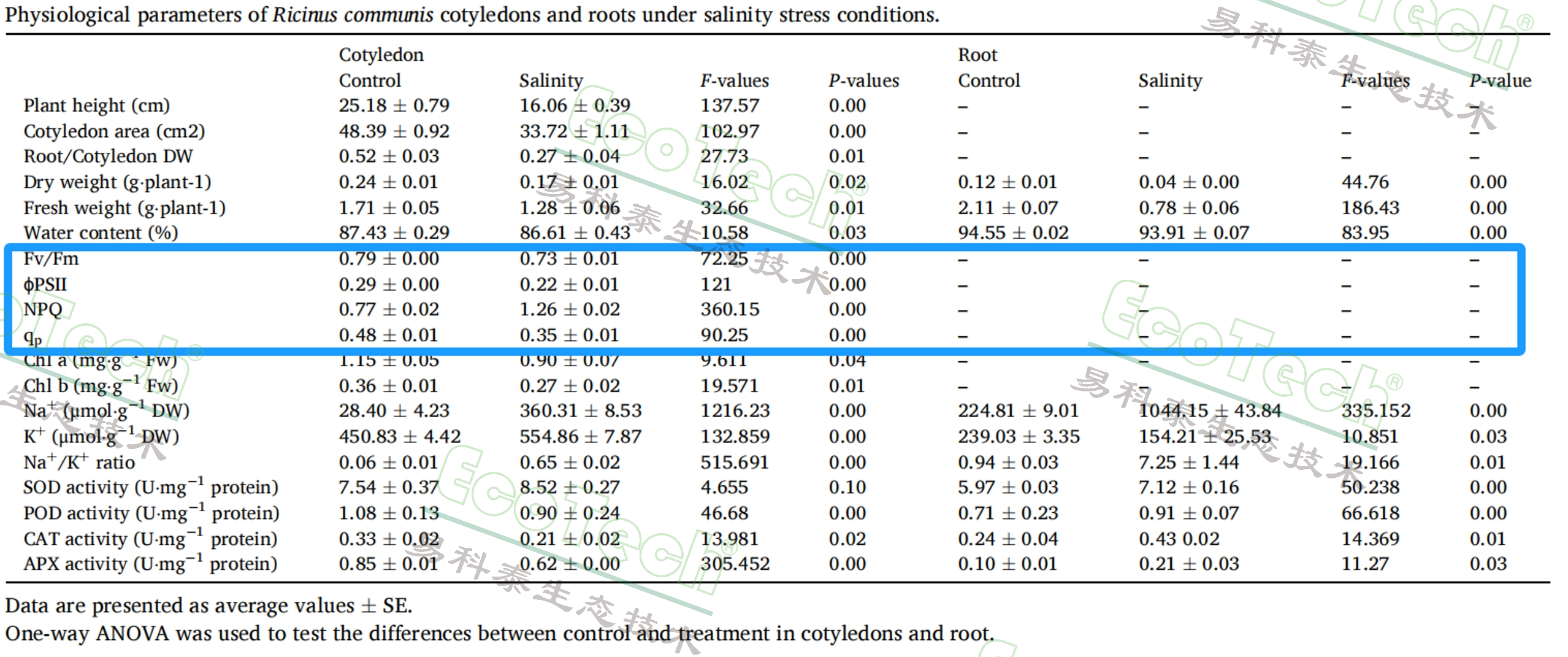
表:盐胁迫条件下蓖麻子叶和根系的生理参数(其中框选部分为使用FluorCam叶绿素荧光成像获得的光合参数)
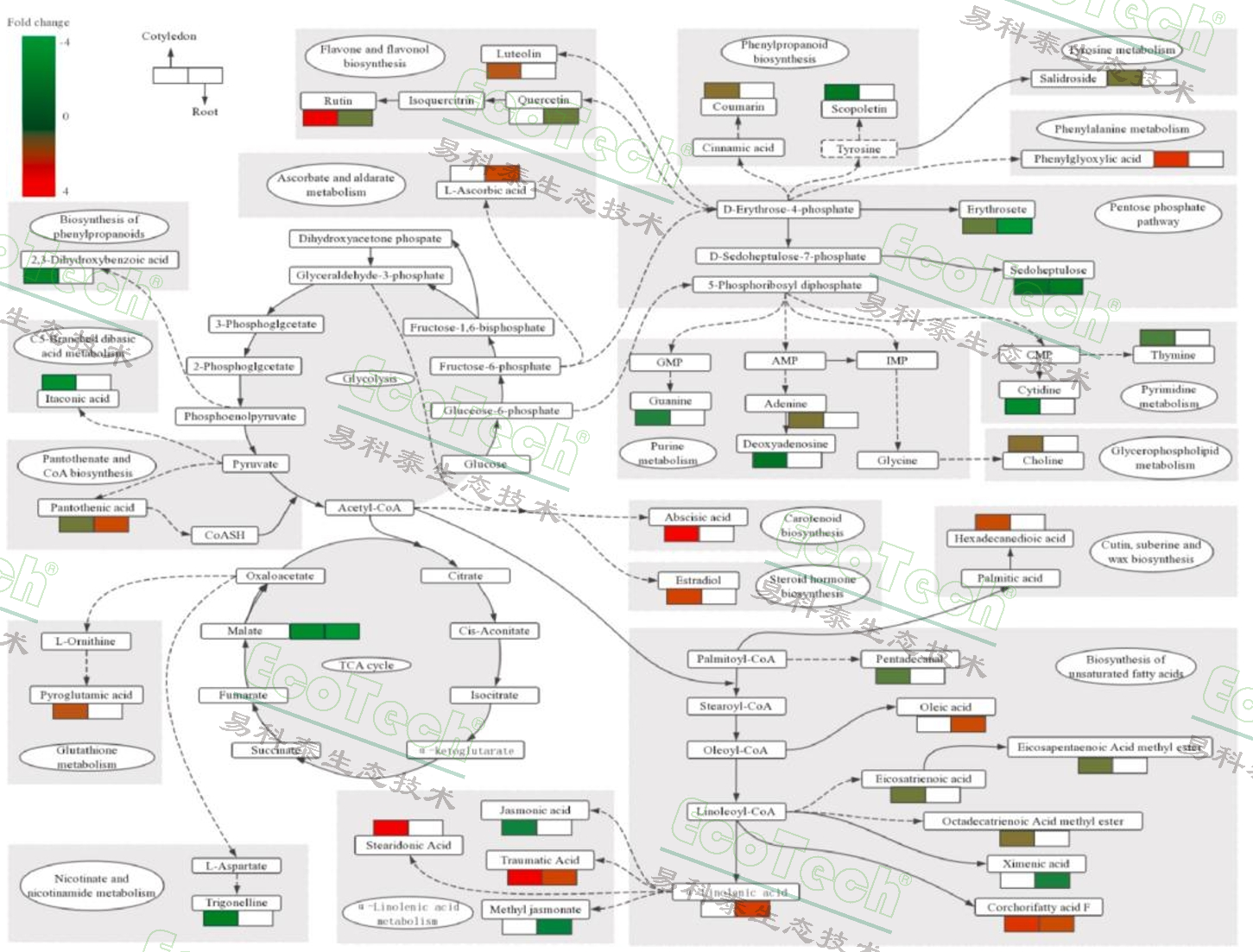
图为盐胁迫下蓖麻子叶和根代谢产物的途径分析。通过KEEG途径分析获得的数据。代谢物含量的增加以红色标记,代谢物含量的减少以绿色标记
案例4:单一和组合环境胁迫对拟南芥(Arabidopsis thaliana)代谢组学和光合作用水平的影响(bioRxiv,2024)
土壤盐度水平的增加、干旱、高温和低温严重威胁着作物生长,而这些环境胁迫经常在作物生长过程中组合发生。这项研究旨在深入了解单一和联合非生物胁迫对拟南芥代谢组水平和光合水平的影响,以及胁迫的相互作用和协同效应。研究揭示了,组合胁迫相比于单一胁迫在拟南芥次级代谢、氧化还原失衡和光合作用表现上产生了更强的协同效应和影响。盐胁迫及其组合对植物生化的影响最为显著。
研究中,在播种38天后将拟南芥幼苗分为9组作并不同处理,每组4个生物学重复。在播种后的38,40,43,44,47天即T0,T1,T2,T3,T4,使用PlantScreen高通量表型分析系统对拟南芥进行RGB成像、叶绿素荧光成像,以检测不同处理对拟南芥形态学特征和光合特性的影响。另外,还通过脂质过氧化、电解质泄露、非靶向代谢物分析、靶向代谢物分析等方法进行代谢组分析。
表型检测结果显示,盐胁迫显著减少了拟南芥的生长面积,而其他胁迫(高温、低温、干旱)在实验期间对生长面积影响不显著。盐胁迫从实验初期就影响了光系统II(PSII)的效率,导致代表光合作用效率的叶绿素荧光参数如Fv’/Fm’等下降。高温胁迫在T4显著增加了非光化学淬灭(NPQ),表明热应力下植物通过增加热耗散来保护光合机构。高温和低温胁迫,都没有影响Fv/Fm,可能是由于处理时间较短。干旱胁迫的单一及组合处理均在9天的处理期内未对光合作用机构造成显著影响,可能是短时间的胁迫未损伤PSII。
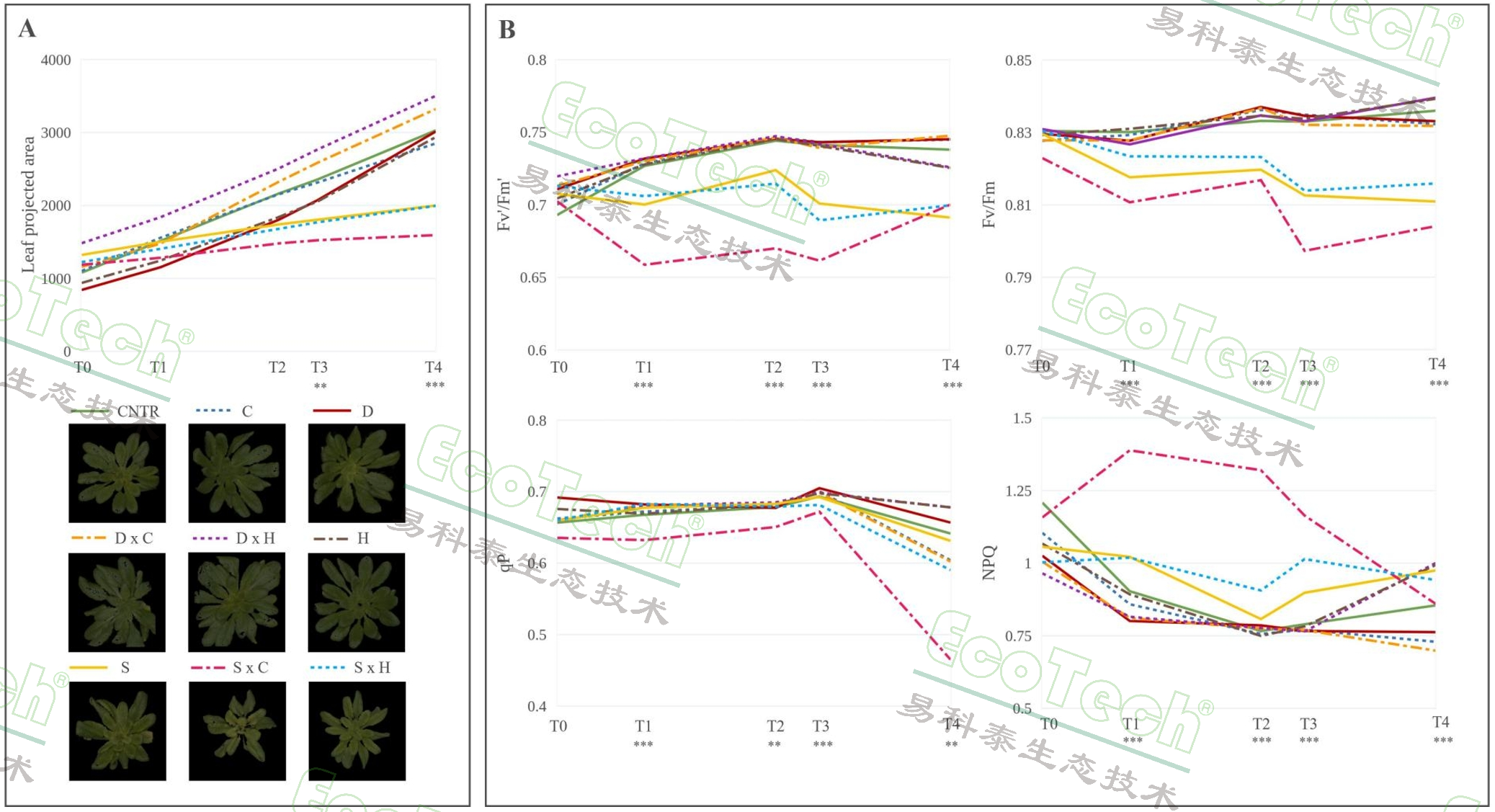
PlantScreen获得的成像数据。左图,叶片投影面积和RGB成像图,右图,叶绿素荧光成像参数结果数据
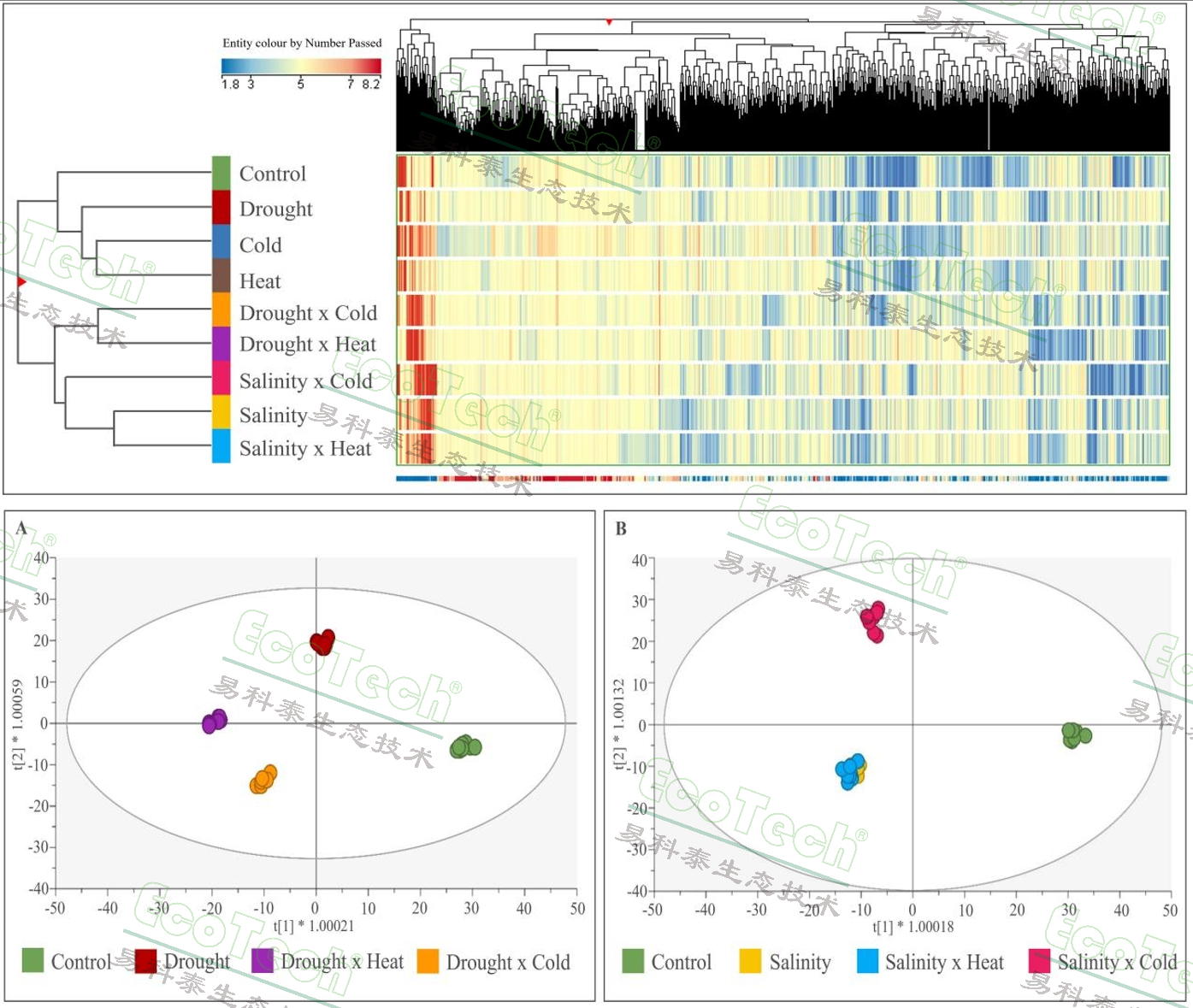
代谢组分析的结果显示,胁迫及其组合显著增加了过氧化氢(H2O2)和丙二醛(MDA)的积累,表明这些胁迫条件下植物经历了更高的氧化应激。非靶向代谢组分析显示,不同的单一和组合胁迫对拟南芥的代谢组有显著影响,导致代谢物的差异表达。通过OPLS-DA模型和VIP分析,识别了在胁迫条件下具有区分潜力的代谢物,包括多酚类、萜类、核苷类、生物碱和硫苷类化合物。盐胁迫及其组合显著增加了脯氨酸的积累,而甜菜碱水平在大多数胁迫条件下降低。
参考文献:
[1] Sorrentino M, Panzarová K, Spyroglou I, et al. Integration of phenomics and metabolomics datasets reveals different mode of action of biostimulants based on protein hydrolysates in Lactuca sativa L. and Solanum lycopersicum L. under salinity[J]. Frontiers in Plant Science, 2022, 12: 808711.
[2] Hao J, Tan J, Zhang Y, et al. Sewage sludge-derived nutrients and biostimulants stimulate rice leaf photosynthesis and root metabolism to enhance carbohydrate, nitrogen and antioxidants accumulation[J]. Chemosphere, 2024, 352: 141335.
[3] Wang Y, Liu J, Yang F, et al. Untargeted LC-MS-based metabolomics revealed specific metabolic changes in cotyledons and roots of Ricinus communis during early seedling establishment under salt stress[J]. Plant Physiology and Biochemistry, 2021, 163: 108-118.
[4] Secomandi E, De Gregorio M A, Castro-Cegrí A, et al. Single and combined effect of salinity, heat, cold, and drought in Arabidopsis at metabolomics and photosynthetic levels[J]. bioRxiv, 2024: 2024.06. 23.600276.