斑马鱼(Danio rerio)作为生物医学研究领域的明星模式生物,凭借其透明胚胎、快速发育等独特优势,在胚胎发育、疾病模型构建与药物筛选等研究方向上大放异彩。近年来,斑马鱼呼吸代谢研究热度持续攀升,尤其在心血管疾病与代谢疾病研究中扮演着愈发关键的角色,为人类健康难题的攻克提供了全新视角与有力工具。
北京易科泰提供生物医学领域斑马鱼呼吸代谢及行为分析的全套技术方案,涵盖斑马鱼成鱼和鱼卵、胚胎、幼鱼的呼吸代谢测量、斑马鱼视频跟踪和行为分析及游泳能力评估,具体方案如下:
- 斑马鱼成鱼呼吸代谢测量系统:提供4、8、12、16、20通道可选。

- 易科泰斑马鱼成鱼呼吸代谢测量定制系统:提供单通道、多通道可选,具有高性价比,能够全自动测量耗氧率(VO2)和标准代谢率(SMR)。
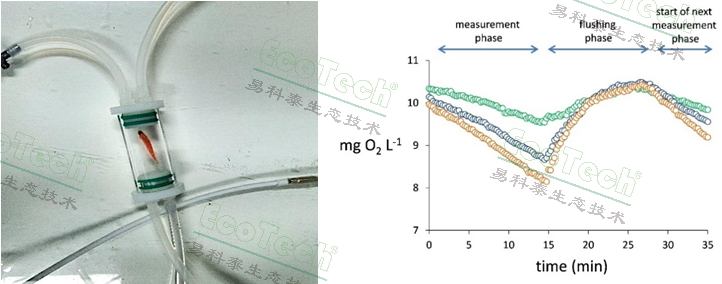
- 斑马鱼胚胎、幼鱼高通量测量系统:提供24至240通道高通量分析,适用于大规模实验,可同时处理多个样本,提高实验效率。
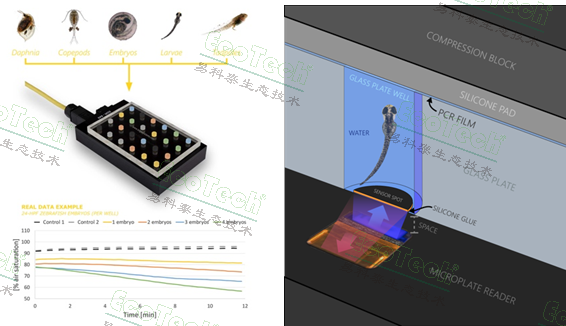
- 斑马鱼游泳呼吸仪:具备全自动测量功能,实时测量和分析耗氧率(VO2),并进一步得到参数标准代谢率(SMR)、最大代谢率(MMR)、有氧代谢范围(AS)、临界游泳速度(Ucrit)和单位距离能耗(COT)。

- 高通量斑马鱼行为分析系统:一体化实验动物视频跟踪及行为分析系统,可对测量96个通道同步测量。该系统能够实时记录斑马鱼的行为数据,为行为学研究提供有力支持。

【案例1】早期生命阶段Grb10a基因敲低对斑马鱼心血管和代谢的影响
英国曼彻斯特大学Bridget L. Evans团队利用斑马鱼作为模型生物,揭示了Grb10a基因敲低对斑马鱼生长、代谢和心血管系统的长期影响,为理解心血管和代谢疾病的发育起源提供了新的视角。
研究人员采用间歇式呼吸代谢测量法,在28℃恒温条件下实时记录斑马鱼氧气消耗率。结果显示,Grb10a基因敲低的斑马鱼在胚胎阶段表现出显著的生长加速和代谢率提高,但心率降低。成年后,Grb10a基因敲低的斑马鱼表现出更高的最大氧气消耗率和更大的有氧范围,这表明其代谢能力显著增强。此外,这些斑马鱼还表现出更高的空腹血糖水平,提示胰岛素信号通能受到影响。
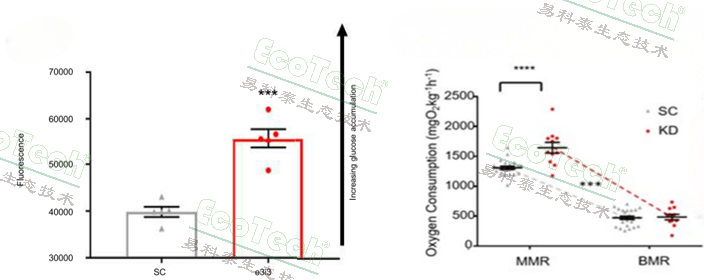
图左:斑马鱼胚胎阶段以2D6P摄取评估代谢率;图右:成年后斑马鱼的最大氧气消耗率(MMR)和基础代谢率(BMR)
这些发现对于理解心血管和代谢疾病的发育起源具有重要意义。Grb10a基因的敲低不仅影响了斑马鱼的胚胎生长和代谢率,还导致了成年后长期的生理和代谢变化。这些结果支持了健康和疾病的发育起源理论(DOHaD),即成年期的疾病可能起源于胚胎期的发育变化。通过在斑马鱼模型中研究Grb10a基因的作用,研究人员为人类心血管和代谢疾病的预防和治疗提供了新的靶点和策略。
【案例2】TDP-43基因突变对斑马鱼运动功能的影响
在一项由麦吉尔大学(McGill University)和蒙特利尔大学(University of Montreal)联合开展的研究中,科学家们利用斑马鱼模型研究其神经退行性疾病研究中的潜在价值。
研究人员使用斑马鱼游泳呼吸仪精确地记录斑马鱼在不同水流速度下的表现,记录其最大游泳速度(Umax)。此外,实验还结合了自由游泳实验,利用相机记录斑马鱼在开放水域中的游泳行为,进一步分析其运动功能的变化。
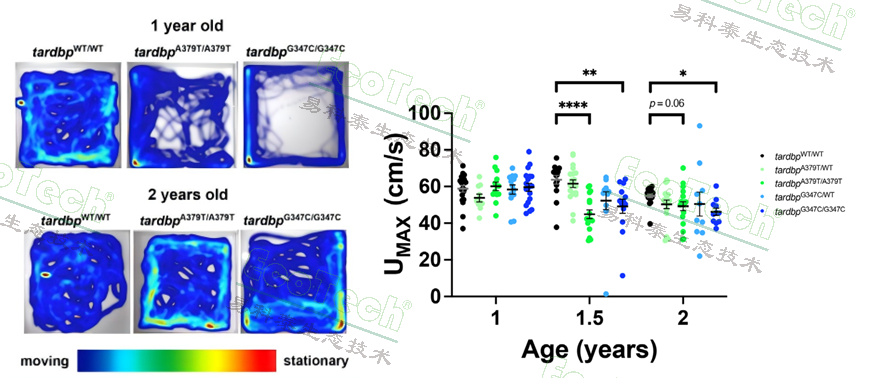
图左:不同基因型斑马鱼的平均游泳速度;图右:不同基因型斑马鱼在游动隧道中的最大游泳速度
实验结果显示,携带TDP-43基因突变(A382T和G348C)的斑马鱼模型在1.5岁时表现出显著的运动功能障碍,其游泳速度明显减慢。这一发现表明,这些突变可能影响了斑马鱼的肌肉功能和神经控制,进而影响其呼吸代谢效率。此外,研究人员还观察到这些模型斑马鱼在2.35至3岁时出现了大脊髓运动神经元的丢失,这与人类肌萎缩侧索硬化症(ALS)的病理特征相似。这些结果不仅揭示了TDP-43突变对斑马鱼运动功能的影响,还为理解ALS的发病机制提供了新的视角。
【参考文献】
- Evans B L, Garner T, De Leonibus C, et al. Transcriptome remodelling and changes in growth and cardiometabolic phenotype result following Grb10a knockdown in the early life of the zebrafish[J]. Cellular and Molecular Life Sciences, 2025, 82(1): 1-27.
- Harji Z A, Rampal C J, Rodríguez E C, et al. TARDBP (TDP‐43) Knock‐in Zebrafish Display a Late‐Onset Motor Phenotype and Loss of Large Spinal Cord Motor Neurons[J]. Annals of Neurology, 2025.
- Sun C C, Yang D, Chen Z L, et al. Exercise intervention mitigates zebrafish age‐related sarcopenia via alleviating mitochondrial dysfunction[J]. The FEBS Journal, 2023, 290(6): 1519-1530.
- Beaver, L.M., Nkrumah-Elie, Y.M., Truong, L., Barton, C.L., Knecht, A.L., Gonnerman, G.D., Wong, C.P., Tanguay, R.L., and Ho, E. (2017). Adverse effects of parental zinc deficiency on metal homeostasis and embryonic development in a zebrafish model. The Journal of Nutritional Biochemistry 43, 78–https://doi.org/10.1016/j.jnutbio.2017.02.006.
- Kim, S., Chung, A., Na, J.E., Lee, S.J., Jeong, S.H., Kim, E., Sun, W., Rhyu, I.J., and Park, H. (2019). Myelin degeneration induced by mutant superoxide dismutase 1 accumulation promotes amyotrophic lateral sclerosis. Glia. 23669. https://doi.org/10.1002/glia.23669.
- Park, K.-H., Ye, Z., Zhang, J., Hammad, S.M., Townsend, D.M., Rockey, D.C., and Kim, S.-H. (2019). 3-ketodihydrosphingosine reductase mutation induces steatosis and hepatic injury in zebrafish. Sci Rep 9, 1138. https://doi.org/10.1038/s41598-018-37946-0.
- Patton, E.E., Zon, L.I., and Langenau, D.M. (2021). Zebrafish disease models in drug discovery: from preclinical modelling to clinical trials. Nat Rev Drug Discov 20, 611–https://doi.org/10.1038/s41573-021-00210-8.
- Yang, J., Shah, S., Olson, T., and Xu, X. (2016). Modeling GATAD1-Associated Dilated Cardiomyopathy in Adult Zebrafish. JCDD 3, 6. https://doi.org/10.3390/jcdd3010006.






